0003. 化学(有機化学):ナフタレンのスルホン化、速度論的支配と熱力学的支配。
戻る
2024年3月6日掲載
通常の有機合成反応の条件では、反応は実質上不可逆の場合が多い。このような不可逆反応における異性体の生成割合は、それぞれの異性体を生じる反応の速度によって決まる。このような場合を、反応は速度論的に支配されている(kinetically controlled)という。
しかし可逆反応では、反応速度の大きい異性体が多く生じるのではなくて、生成系の熱力学的により安定な方がより多く生じる。このような反応を、熱力学的に支配されている(thermodynamically controlled)という。
ナフタレンを濃硫酸でスルホン化すると、低温ではα-ナフタレンスルホン酸を、高温ではβ-ナフタレンスルホン酸を多く生じ、その割合は反応温度によって決まる。
ナフタレンスルホン酸の生成速度は、α-スルホン酸の方がβ-スルホン酸よりも大きい。その理由は、この反応が芳香族求電子置換反応であることに起因する。それは、反応の過程におけるσ錯体の安定性を比べてみれば分かる。
ここでσ錯体とは、最も構造の簡単な芳香族化合物であるベンゼンの求電子置換反応で説明すれば、図1の[1]のような形の中間体のことである。この反応の機構は、正電荷を帯びた求電子体E+(electrophile)がまず芳香環に付加してσ錯体を作り、次いでこのσ錯体からプロトンが脱離して芳香環を再生するという、2段階反応であることが分かっている。
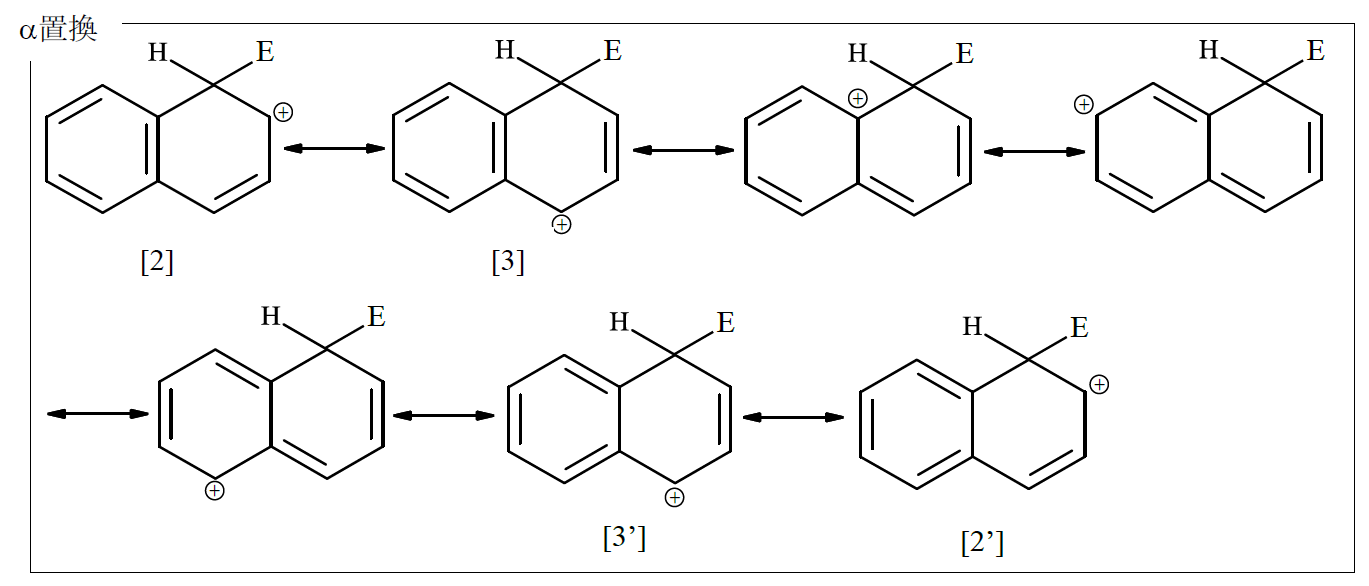
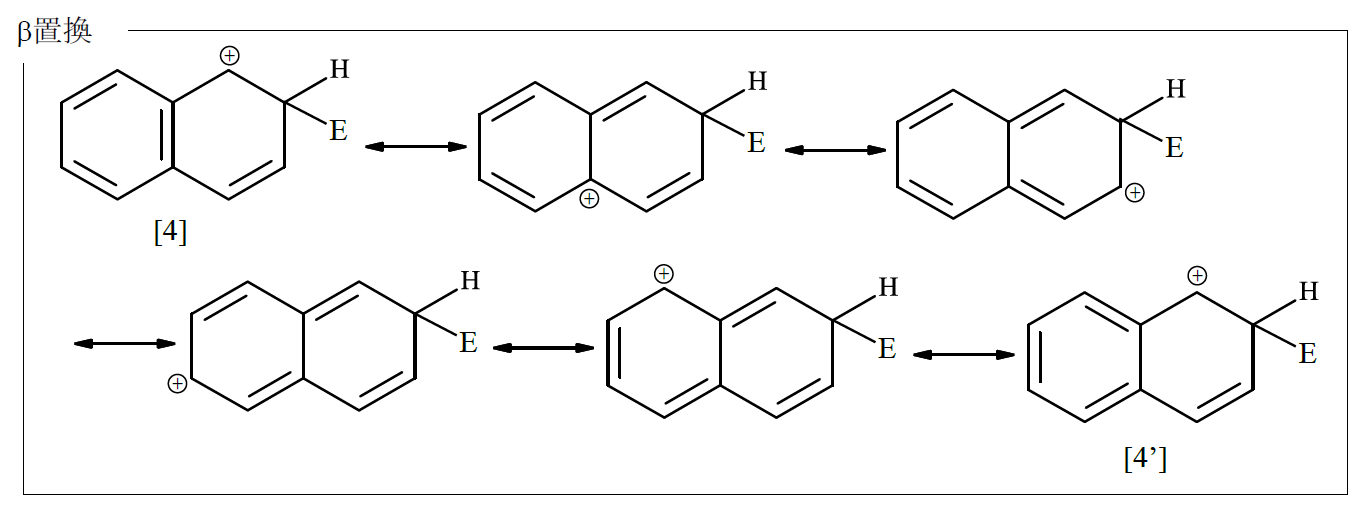
ナフタレンの求電子置換反応に話を戻せば、α置換とβ置換のσ錯体の限界構造式は、それぞれ次のようになっている。
共鳴構造の数ではα置換がβ置換より1個多い。またα置換では、[2]、[2']、[3]、[3']のようにベンゼン環の芳香族性を保持した限界構造式が4つあるのに対して、β置換では2つあるのみであるから、α置換のσ錯体の方がはるかに安定になる。結果として、ナフタレンスルホン酸の生成速度は、α-スルホン酸の方がβ-スルホン酸よりも大きくなる。
表1より、反応温度が80 ℃以下の不可逆的条件では、速度支配になってα-スルホン酸を多く生じる。160 ℃以上の高温では、実質的に可逆反応になり、熱力学的に有利なβ-スルホン酸の生成反応が進みやすくなるのである。
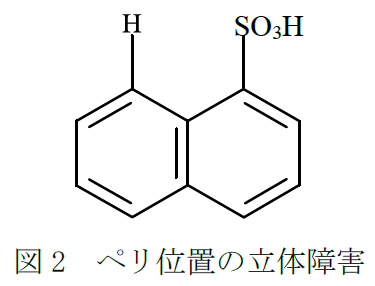
α-ナフタレンスルホン酸のスルホン基は、8-位置(またはペリ位置)の水素によって立体障害を受けているので、障害のないβ-スルホン酸の方がα-スルホン酸より安定なのである(図2)。
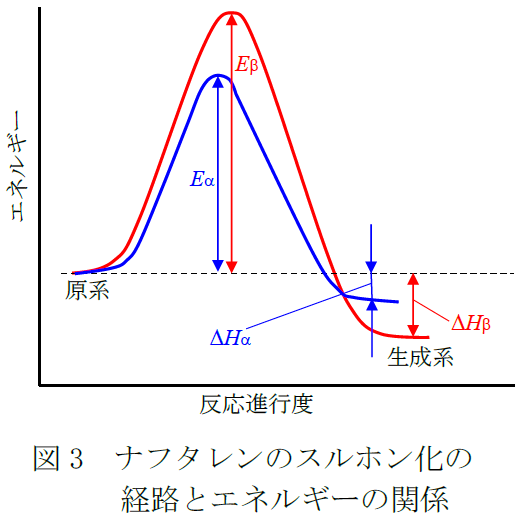
ナフタレンのスルホン化のα置換とβ置換のエネルギーの関係を図式的に表したのが図3である。
【参考文献】
飯田弘忠、「有機合成化学」、培風館(1975)。
戻る
Copyright(C) 2017 KONISHI, Shoichiro. All rights reserved.